|
Вверх
на главную страницу
История
Факты
Идеи
Люди
Библиография
Конференции
|
|
РАДИАЦИОННАЯ БИОЛОГИЯ. РАДИОЭКОЛОГИЯ, 2003, том 43, № 3, с. 306-309 Материалы III Международного Симпозиума
В. В. Белов, Е. Л. Мальцева, Н. П. Пальмина
Цель данной работы заключалась в изучении методом спинового зонда действия природного анти-оксиданта a-токоферола ( a-тф) от концентраций 10-3 моль/л до разведений 10-25 моль/л in vitro на структурные характеристики (микровязкость, параметр упорядоченности) мембран эндоплазматического ретикулума клеток печени мышей. В качестве спиновых зондов использованы стабильные нитроксильные радикалы - 16-доксилстеариновая кислота (с глубиной локализации ~20А) и 5-доксилстеариновая кислота (с глубиной локализации ~5А). Показано, что при определенных концентрациях a-тф вызывает увеличение микровязкости глубоколежащих областей липидного бислоя и жесткости поверхностных. Полученные концентрационные зависимости имеют полимодальный профиль, характерный для действия веществ в сверхмалых дозах. Кроме того, в глубоколежащих областях липидного бислоя микросомальных мембран обнаружены увеличение количества и появление более высококооперативных термоиндуцированных структурных переходов, а также увеличение их эффективной энергии активации с ростом температуры при добавлении различных доз a-тф.
Материалы и методика
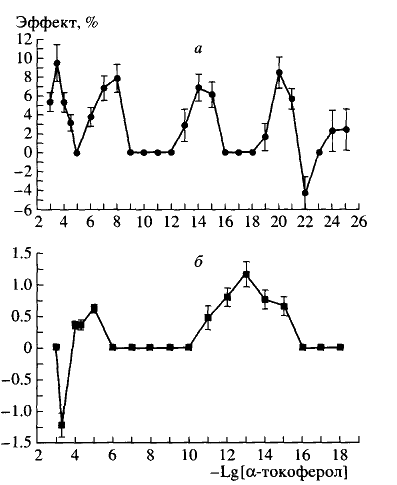
Растворы a-тф были получены методом последовательного разведения через один порядок его исходного 10 моль/л раствора спиртом высокой очистки фирмы "Merck" (Германия) до концентрации 10-3 моль/л, а затем дистиллированной водой. При статистической обработке данных надежность принималась равной 95%. Для определения достоверности отличия опыта по сравнению с контролем применялся Mest. Результаты и обсуждение В результате изучения влияния a-тф на микровязкость глубоколежащих областей липидного бислоя мембран при температуре 293К были получены характерные для действия веществ в СМД полимодальные концентрационные зависимости эффектов, выраженных в процентах по отношению к контролю, которые представлены на рис. 1, а. Важно отметить, что все концентрации a-тф (кроме 10-22 моль/л) вызывают увеличение параметров tс1 и tс2, т.е. микровязкости в области локализации зонда С16, причем величины эффектов при действии СМД a-тф сопоставимы с изменениями, вызванными действием его "физиологических" концентраций (10-9 - 10-6 моль/л).
Эффективная энергия активации (кДж/моль/л) термоиндуцированных структурных переходов в глубоколежащих областях (~20 А) липидного бислоя микросомальных мембран клеток печени мышей в контроле и при действии a-токоферола in vitro в различных концентрациях. 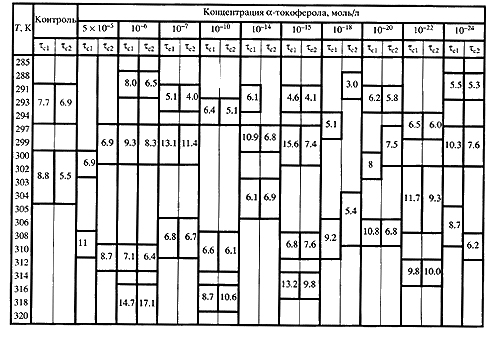
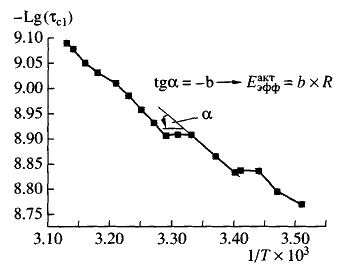
Структурные переходы характеризуются точками излома между линеаризованными участками температурных зависимостей, представленных в аррениусовых координатах -lgtс от 1/Т, а эффективная энергия активации переходов определялась из тангенса угла наклона каждого линеаризованного участка графика, как показано на рис. 2. В контроле и при действии a-тф в концентрациях 5х10-5 и 10-18 моль/л наблюдается минимальное количество переходов - два. Максимальное число переходов (четыре) отмечено при действии доз 10-6 и 10-15 моль/л , при которых имели место максимумы на дозовой зависимости действия a-тф при температуре 293К. Также наблюдаются изменения в положении и ширине переходов по сравнению с контролем. При всех изученных концентрациях a-тф, кроме 10-6 и 10-24 моль/л , в том числе и в СМД, наблюдается уменьшение количества широких переходов и преобладание узких, что говорит об увеличении кооперативности переходов по сравнению с контролем. Вместе с кооперативностью происходит увеличение и эффективной энергии активации переходов, поскольку эти величины взаимозависимые. Ко всему прочему, в целом наблюдается рост ее величины с ростом температуры.
Изучались также и изменения в жесткости (DHП) поверхностных областей (~8А) липидного бислоя микросомальных мембран под действием a-тф в диапазоне концентраций 10-18-10-3 моль/л при температуре 293К. На рис. 1, б представлена полученная концентрационная зависимость эффектов a-тф, имеющая бимодальный вид, характерный для действия веществ в СМД, с максимумами в дозах 10-13 и 10-5 моль/л , между которыми лежит широкая "мертвая зона", охватывающая
пять порядков по концентрации. Действие a-тф во всех концентрациях, кроме 5х10-4 моль/л , вызывает увеличение параметра DHП, что говорит об увеличении жесткости мембраны. При этом эффект в области СМД в 2 раза выше, чем в области обычных "физиологических" концентраций a-тф. Таким образом, достоверно показано, что действие a-тф в широком диапазоне разведений, включающем СМД, вызывает структурные изменения как в поверхностных, так и в глубоколежащих областях липидного бислоя, которые при определенных концентрациях a-тф приводят к повышению жесткости липидов микросомальных мембран. Все описанные выше изменения позволяют сделать предположение о концентрационнозависимом стабилизирующем эффекте действия a-тф на структуру липидного бислоя мембраны. Список литературы
|